의료용으로 레이저를 사용하기 위해서는 레이저빔이 인체조직에서 어떻게 전파되며, 어떠한 상호작용을 하는가를 이해하는 것이 필수적이다. 레이저는 각기 자외선대, 가시광선대, 적외선대에 속하는 고유파장을 가지고 있는데, 레이저 시술에 있어서 가장 중요한 매개변수가 바로 이 파장이다. 파장이 다른 레이저들이 각각 생체조직에 미치는 영향이 서로 다른 이유는 파장에 따라 조직에 흡수되고 산란하는 비율이 달라 결과적으로 조직 침투력이 다르기 때문이다. 그러므로 시술 목적에 맞추어 가장 적절한 파장대의 레이저를 선택하여 사용하여야 한다.
조직에 조사된 다양한 파장을 가진 레이저는 출력에 따라 세 가지의 반응을 일으키는데, 매우 낮은 출력의 레이저는 세포를 파괴하지 않고 특정한 화학반응과 신진대사 반응을 일으키며, 높은 출력의 레이저는 조직의 온도를 높여 열로써 조직을 파괴하고, 매우 높은 출력의 레이저는 조직에 열을 거의 발생시키지 않고 기계적 과정을 통해 조직을 파괴한다.
(1) 광열효과(Photothermal effect)
1) 레이저의 광열효과
 |
| 사진 3-6-F-2. 조직에 대한 광열효과를 이용하는 CO₂레이저 치료 |
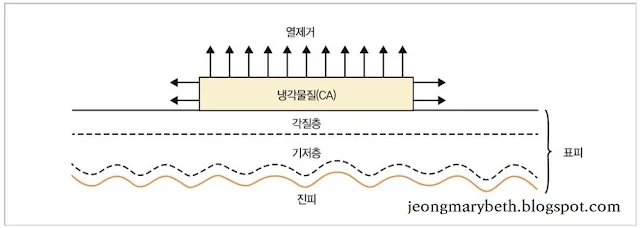
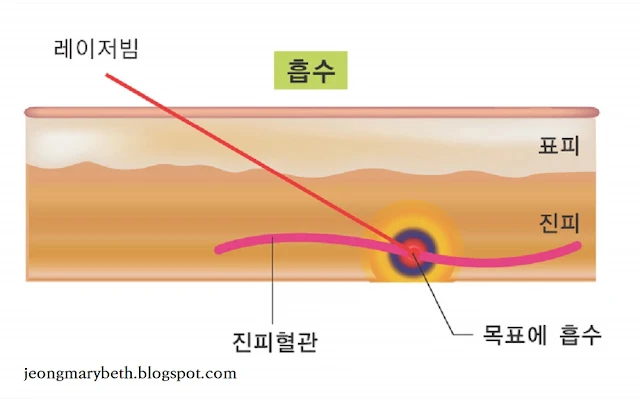
레이저빔이 조직에 조사되었을 때 나타나는 반응은 레이저의 파장, 레이저빔의 강도, 조사시간에 따라 다르며, 또한 표적물질의 성질과 조직의 구성상태에 따라 다르다. 레이저빔의 조직에 대한 주작용은 국소적인 열 효과인데, 비록 세포와 조직의 종류에 따라 레이저를 흡수하는 정도는 다를지라도 레이저의 열 효과는 결과적으로 조직에 탈수, 응고, 기화의 세 가지 현상을 유발한다. 레이저 시술 시 이러한 세 가지 현상 중 한 가지만을 응용하기도 하고 두세 가지를 복합적으로 이용하기도 한다.
 |
| 그림 3-6-F-3~6. 레이저빔의 조직에 대한 작용 |
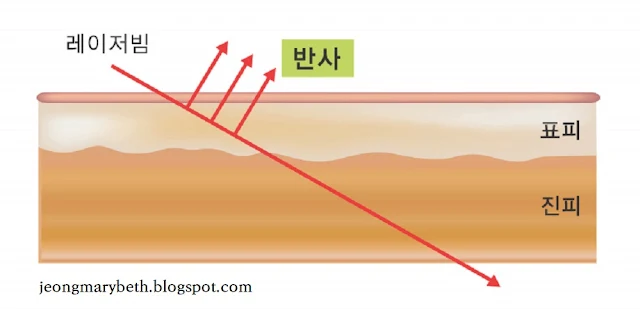
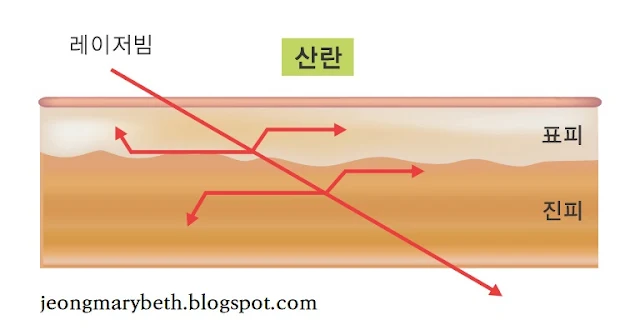
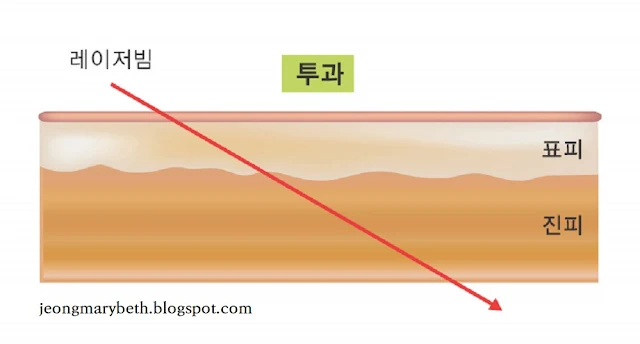
레이저의 열에너지에 의한 손상은 우선 레이저빔이 조직에 흡수되어야만 효과를 나타내는데, 예컨대 피부 레이저빔이 금속에 닿았을 때는 금속에 아무런 변화 없이 반사되어 버리고, 유리에 닿았을 때는 유리에 아무런 변화 없이 투과되어 버린다. 또한, 레이저빔은 진행 방향을 바꾸어 굴절되거나 임의로 산란할 수 있다. 인체에 레이저를 조사할 때 대부분의 레이저 에너지는 조직에 흡수되지만, 일부 에너지는 조직에서 반사되고, 일부 에너지는 인접 조직으로 산란하고, 일부 에너지는 조직을 투과한다. 임상에서 사용되는 레이저는 피부에 직각으로 조사하게 되므로 굴절은 보이지 않는 경우가 많고 무시할 만큼 작다. 레이저빔이 피부에 조사되는 경우 일부는 표면에서 산란(표면산란) 및 반사가 되고, 일부는 조직에 침투하여 산란(내부산란) 및 흡수가 되고, 나머지는 조직을 투과한다. 보통 레이저 시술 시 레이저가 조직을 투과하여 표적 물질에 흡수될 경우, 임상 결과가 가장 좋다.
 |
| 그림 3-6-F-7. 레이저 열 손상 |
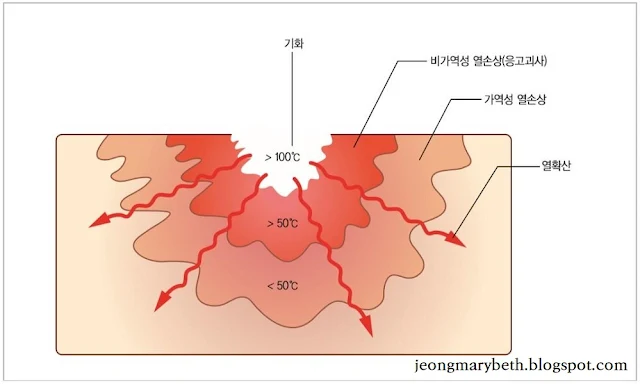
레이저가 조직에 흡수되면 빛에너지가 열에너지로 전환되어 조직의 온도가 올라가게 된다. 온도가 상승함에 따라 조직의 변화는 달리 나타나는데, 조직의 열 손상은 온도와 노출 시간에 비례하여 증가하므로 온도가 높을수록, 노출 시간이 길수록 조직의 열 손상은 증가한다. 온도에 따른 조직의 변화로, 50°C 이하에서는 가역적인 변성을 초래하여 시술 후 정상 상태로 환원이 가능하지만, 60~100°C에서는 조직의 단백질이 변성 또는 응고되어 정상 상태로 환원되지 못하고 비가역적인 열 손상이 초래되어 조직이 괴사한다. 혈액의 응고는 68~90°C에 일어난다. 온도가 100°C가 넘으면 세포 안의 물이 끓게 되고 증기로 기화되며, 이때 생긴 수증기로 인하여 세포가 터지고 혈관이 손상을 입게 된다. 150~250°C 이상으로 온도가 오르면 조직은 탈수가 생기면서 숯(char)을 형성하며 탄화되지만, 300°C 이상 온도가 상승하면 조직의 완전한 기화가 이루어지며, 이때는 조직의 탄화물도 남지 않게 된다. 기화되어 없어져 버린 부위는 비가역성 열손상구역, 응고괴사구역, 가역성 열손상구역의 순서로 둘러싸여 있게 된다.
 |
| 그림 3-6-F-8. 레이저별 투과 깊이 |
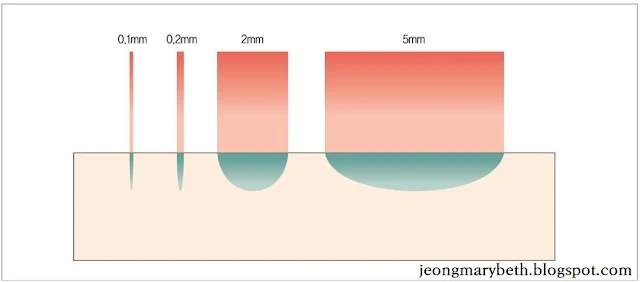
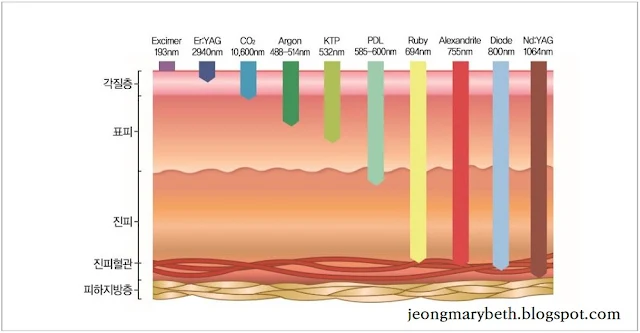
열 손상을 입은 결합조직이 복구되는 양상은 레이저의 양상과는 상관없이 똑같아서 손상된 부위에는 육아조직이 형성되며, 시술 후 흉터 발생 여부와 색소변화는 열 손상의 깊이와 정도에 달려있다. 레이저 시술에 사용되는 레이저들은 각기 파장, 침투깊이 및 산란 정도가 다르므로 열 손상을 일으키는 깊이가 각기 다르다. 예컨대, CO₂레이저는 얕은 층에 있는 조직의 수분에 흡수되어 버리므로 별로 분산되지 않고 피부를 0.1mm 정도밖에 침투하지 못하지만, 엔디야그레이저는 적게 흡수되고 분산되면서 깊이 침투하여 4~6mm를 침투하게 된다.
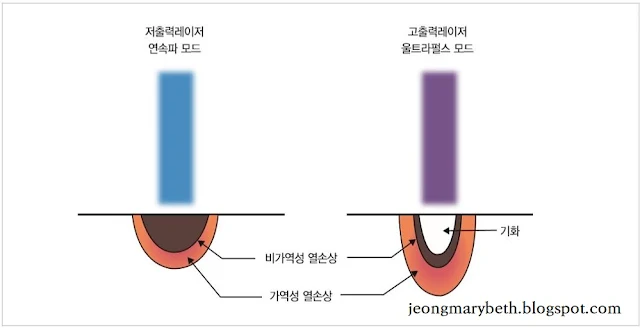
방출한 에너지의 총량은 출력과 조사기간에 비례하므로, 일정한 총에너지량을 유지하려면 출력이 감소할 때는 조사기간을 비례적으로 늘려야 하며, 반대로 출력을 증가시키는 경우는 조사기간을 비례적으로 짧게 해야 한다. 이때 총에너지량이 동일하더라도 출력의 강약에 따라, 조사기간의 장단에 따라 조직에 나타나는 효과는 다르다. 예컨대, 방출한 총에너지량이 동일해도 출력을 더 높이고 조사기간을 더 짧게 하면 조직이 더 많이 증발하고 비가역성 열손상부위는 더 작게 되며, 출력을 더 낮추고 조사기간을 더 길게 하면 조직이 더 적게 증발되고 비가역적 열손상부위는 더 커진다. 그러므로 고출력의 CO₂레이저는 이러한 원리를 이용하여 피부 표면의 기화를 최대로 하고, 반면 주변의 열 손상을 최소로 줄일 수 있어 레이저박피술에 유용하게 사용된다.
 |
| 그림 3-6-F-9. 출력에 따른 조직반응 비교 |
2) 선택광열융해(Selective photothermolysis)
1983년 Anderson과 Parrish는 표적 조직에만 열 손상을 입히고 그 주위 조직에는 열 손상이 생기지 않게 하는 '선택광열융해'라는 획기적인 레이저 치료 개념을 발표하였다. 치료하고자 하는 피부병변의 표적 조직에만 선택적으로 잘 흡수되는 레이저빔을 열이완시간보다 더 짧은 기간만 조사하면, 표적 조직에만 선택적으로 열 손상이 일어나고 주위의 정상 조직은 영향을 받지 않는다는 것이다. 그러므로 이러한 개념으로 레이저 시술을 하게 되면, 병변만 제거되고 주위의 정상 조직은 열 손상을 입지 않아 흉터가 생길 위험이 없게 된다.
최적의 선택광열융해를 이루기 위한 3대 요소
1. 레이저의 파장: 병변에 최대로 흡수되는 파장
2. 레이저 조사시간: 병변의 열이완시간보다 짧은 조사시간
3. 레이저 출력: 주위 조직에 손상을 주지 않을 정도의 순간적으로 높은 에너지
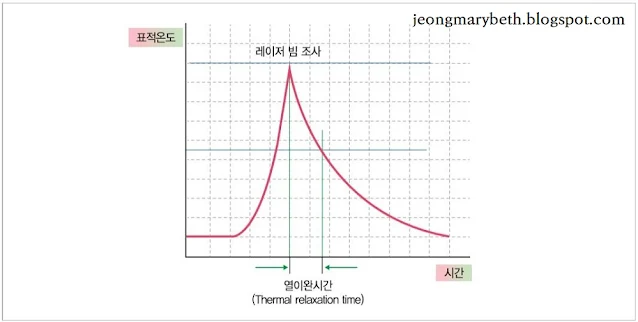
3) 열이완시간(Thermal relaxation time, TRT)
레이저가 조직에 흡수되면 빛에너지가 열에너지로 전환되어 조직의 온도가 올라가게 되는데, 열이완시간은 레이저를 조사한 직후의 최고온도가 50% 이하로 식는 데 걸리는 시간을 의미한다. 바꾸어 말하면 빛에너지를 흡수한 표적 발색단에서 발생되는 열에 의해 올라간 온도가 주위로 열을 빼앗겨서, 올라간 처음 온도의 1/2로 줄어드는 데 걸리는 시간을 말한다. 이때 표적 발색단 주위의 온도도 상승하게 되고, 전도되는 열이 너무 많으면 주위 조직도 변성을 일으킬 수 있음은 당연하다.
 |
| 그림 3-2-5-F-10. 열이완시간 |
열이완시간은 조직의 냉각에 필요한 시간으로, 선택광열융해의 목표는 주위 조직의 열 손상 없이 표적 발색단만을 파괴하는 것이므로, 열이완시간보다 더 짧은 기간만 레이저를 조사하면 표적 조직에만 선택적으로 열 손상이 일어나고 주위의 정상 조직은 영향을 받지 않는다는 이론이다.
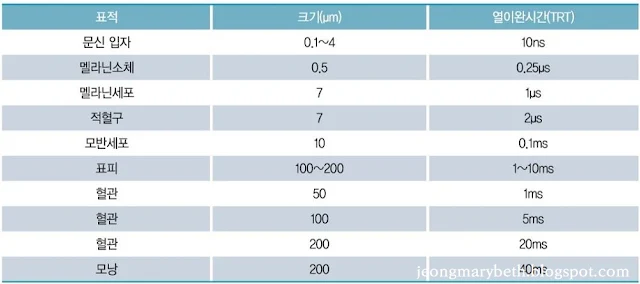 |
| 표 3-6-F-1. 표적별 열이완시간 |
하지만 실제 레이저 시술 시 발색단과 표적 조직이 일치하지 않는 경우가 많으므로 확대 이론(extended theory of selective photothermolysis)이 이후 다시 제시되었는데, 제모를 위한 레이저의 경우에는 멜라닌색소를 가진 털바탕질과 털줄기의 온도를 올려 열 확산(heat diffusion)을 통해 주변의 모낭줄기세포를 파괴할 수 있어야 하며, 혈관 치료는 발색단인 헤모글로빈 그리고 적혈구뿐만이 아니라 열이 확산되어 혈관 벽의 내피세포가 파괴되어야 레이저의 치료 효과가 나타날 수 있다. 그러므로 제모나 굵은 혈관의 치료를 위해서는 열이완시간(TRT)보다 더 긴 열손상시간(thermal damage time, TDT)이 중요한 것으로 생각되고 있다.
여기서 열손상시간은 주위의 정상 조직을 손상시키지 않고 비가역적인 표적의 손상을 일으키는 데 필요한 시간으로, 발색단으로부터 열 확산을 통해 파괴시키려는 목표물의 가장 바깥 부분이 손상되는 온도까지 걸리는 시간을 의미한다. 따라서 레이저를 조사하는 시간은 열손상시간보다는 짧거나 같아야 한다.
4) 발색단(Chromophore)
유기 화합물의 색을 나타내는 원자단을 발색단이라 한다. 1876년 Otto N. Witt가 발표한 ‘유기화합물의 발색에 관한 이론’에서 색을 가지기 위해서는 물질분자 속에 발색단이라는 원자단이 있어야 하며, 발색단을 함유한 화합물을 색원체(chromogen)라고 명명하였다. 색원체 자체의 색깔은 연하고 엷어서 색소로 될 수 없지만, 여기에 특정한 기를 도입하면 색의 강도가 커지고 섬유에 염착되기가 쉬워져 염료로서의 특질을 가지게 되는데, 이와 같이 작용하는 기를 조색단(auxochrome)이라고 명명하였다. 이 견해는 현재의 발색이론으로 보아도 합리적인 면이 있으므로 이 용어가 현재까지도 사용되고 있다.
또한, 양자역학에 의한 발색이론의 발전으로 물질에 따른 빛의 선택흡수의 본질이 해명되어 발색단은 빛을 흡수하는 원자 또는 원자단을 이르는 말로서, 레이저와 관련하여 발색단은 '빛을 흡수하는 피부 구성성분'으로 이해될 수 있다. 피부에서 빛을 흡수하는 발색단은 물, 헤모글로빈, 멜라닌, DNA, RNA, 단백질(콜라겐, 엘라스틴), 지방, 카로틴, 문신색소 등이다.
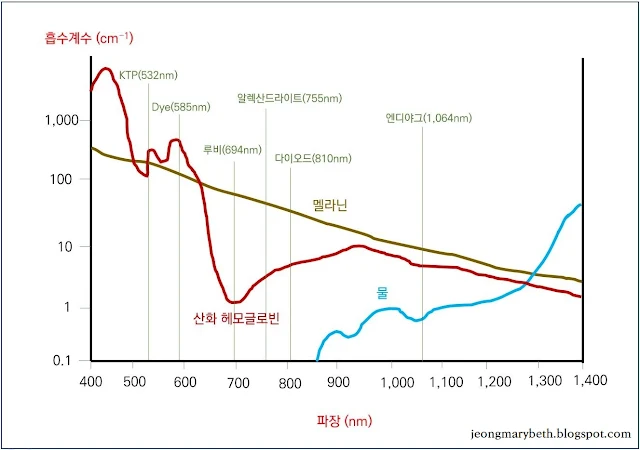 |
| 그림 3-6-F-11. 3가지 중요한 피부 발색단의 흡수 스펙트럼 |
레이저 시술과 관련하여 알아야 할 피부의 주요한 발색단은 멜라닌과 산화혈색소 및 문신색소 등이다. 또한, CO₂레이저 및 어븀야그레이저 등의 빔은 수분에 잘 흡수되므로 이들 레이저에 대해서는 물이 발색단으로 작용한다. 각각의 발색단은 특정 파장을 선택적으로 흡수하는데, 특정 발색단에 선택적으로 잘 흡수되는 파장의 레이저빔을 조사하면 산란은 최소로 되고 흡수는 최대로 되어 조직에 열 손상을 가져오게 된다. 오랫동안 조사하면 그 발색단이 들어있는 표적 조직은 물론이고 그 주위 조직에도 열이 전도되어 열 손상을 초래하는데, 이는 열에너지가 한정된 기간 동안만 흡수된 조직에 머무르다가 곧 그 주위 조직으로 확산되기 때문이다.
이러한 주위 조직에 대한 불필요한 열 손상을 막기 위해 선택광열융해의 개념이 도입되었고, 열이완시간보다 짧은 기간만 레이저를 조사하여 표적 조직에만 선택적으로 열 손상을 일으키고 주위의 정상 조직은 보호할 수 있게 되었다. 피부혈관에 있는 주된 발색단은 혈색소와 산화혈색소로 혈관 내에 고농도로 들어있는 산화혈색소가 잘 흡수하는 파장은 418nm, 577nm, 542nm의 순이다. 멜라닌은 351~1,064nm 범위의 넓은 스팩트럼을 흡수한다.
5) 초점상태
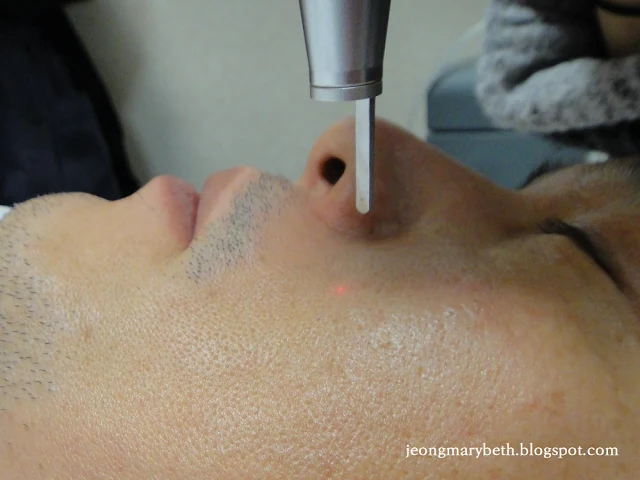
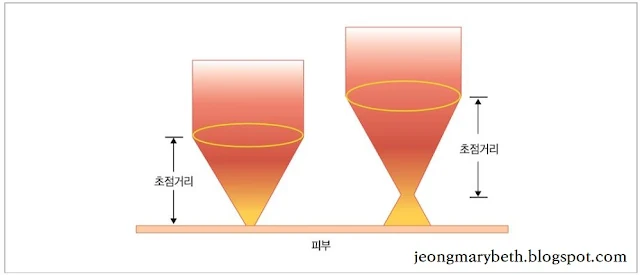
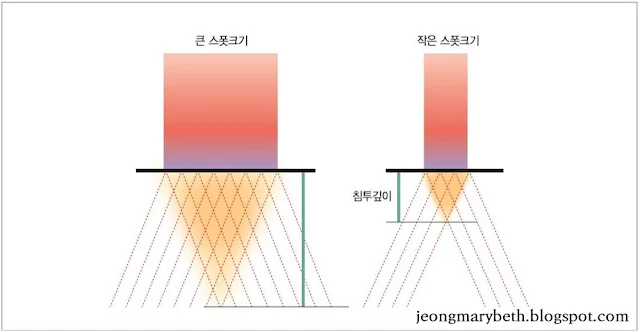
열파괴용 레이저(thermal destructive laser)에서 레이저빔은 초점이 맞춰진 상태에서 출력밀도가 최대가 되며, 초점거리를 벗어나면 출력밀도가 현저히 감소하게 된다. 출력밀도란 단위면적에 가해진 레이저 에너지양을 말하는데, 조직의 열 손상 정도와 관련이 있다. 출력밀도는 레이저의 출력을 선택하기에 따라서 증감할 수 있으며, 동일한 출력을 넓게 조사할수록 출력밀도는 감소하고, 반대로 좁게 조사할수록 출력밀도는 증가한다. 그러므로 동일한 양의 레이저 에너지를 초점거리에 맞추어(focusing) 스폿크기를 작게 하여 조사하면 그 효과가 최대로 나타나 조직이 절개되지만, 초점거리를 벗어나게 하여(defocusing) 스폿크기를 크게 한 후 조사하면 그 효과가 거리의 제곱에 반비례하여 감소되므로 조직이 응고된다. 따라서 시술 시 핸드피스의 레이저 빔 출구와 조직 간의 거리를 적절히 조절할 줄 알아야 한다.
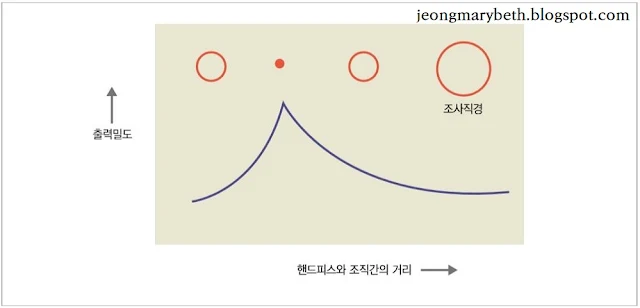 |
| 그림 3-6-F-12. 핸드피스와 조직 간의 거리와 출력밀도와의 상관관계 |
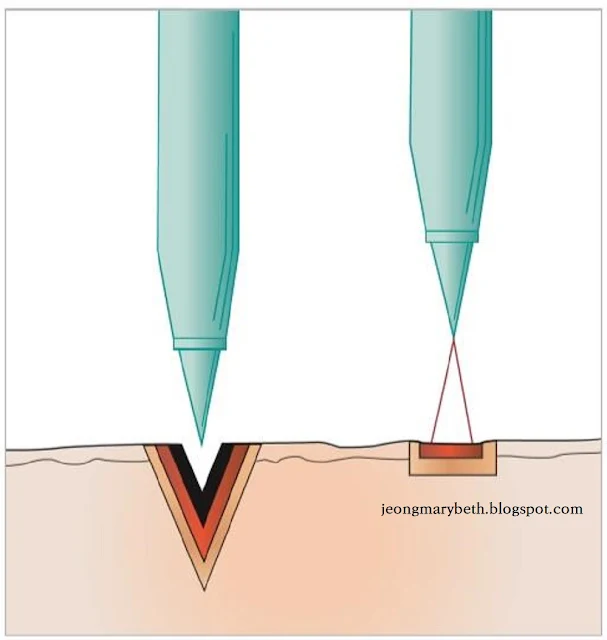 |
| 그림 3-6-F-13. 초점상태에 따른 절개와 응고 |
레이저빔의 출구와 표적 조직 간의 거리가 초점거리보다 멀어질수록 스폿크기가 커지고, 초점거리에 도달하면 스폿크기가 최소가 되지만, 초점거리가 이보다 더 가까워지면 스폿크기가 다시 커지게 된다. 그러므로 동일한 출력이라면 레이저빔의 출구와 표적 조직 간의 거리를 초점에 맞추어 사용하여야 출력밀도가 최고가 된다. 출력밀도가 클수록 조직의 파괴가 빨라지고 주위 조직의 열 손상은 적으며, 출력밀도가 적을수록 조직이 파괴는 느려지고 주위 조직의 열 손상은 커진다. 실제로 출력밀도를 낮게 하여 혈관, 난관, 정관 등을 접합(welding)하려고 노력하고 있다.
(2) 광기계적 효과(Photomechanical effect)
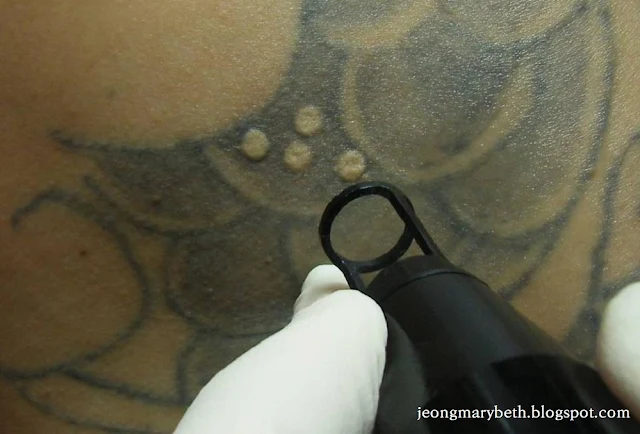 |
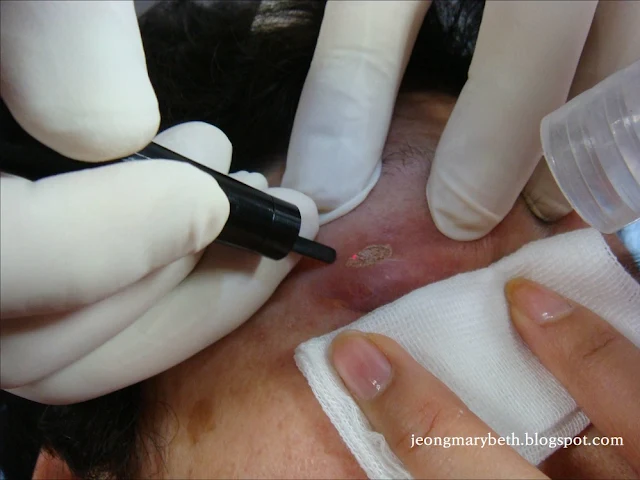
| 사진 3-6-F-14. 큐스위치 엔디야그레이저의 광기계적 효과를 이용한 문신 제거 |
레이저빔은 조직에 광열효과를 주는 것 외에도, 광 에너지에 의한 기계적 효과로 표적 조직을 파괴할 수 있다. 이처럼 광기계적 효과를 보이는 레이저는 레이저 조사시간이 극히 짧고 매우 출력이 높아야만 주위 조직의 손상 없이 표적 조직만의 파괴가 가능하다. 이를 광붕괴(photodisruption)라고도 하는데, 일정한 공간 안에서 짧은 시간 동안에 급격한 열의 가열이 일어나면서 발생하는 탄성적인 팽창에 의한 현상으로, 이러한 갑작스러운 열적 팽창은 충격파를 발생시켜 주위 조직에 손상을 일으킬 수 있다. 그러므로 이 경우는 열에 의한 조직파괴가 아니라 충격파에 의한 기계적인 파괴인 것이다.
광기계적 효과의 기전은 플라스마 형성, 충격파, 공동, 제트 형성으로 설명되고 있다. 이처럼 조직에 열을 거의 발생시키지 않고 기계적 과정을 통해 조직을 파괴하는 레이저에는 엑시머레이저(excimer laser)와 큐스위치 레이저(Q-switched laser) 등이 있다. 엑시머레이저는 조직에 열을 거의 발생시키지 않고 매우 높은 출력으로 세포를 이루고 있는 분자의 화학결합을 파괴하여 조직을 괴사시키는 레이저이다. 할로겐 화합물 기체 중 한 가지를 매질로 사용하여 전기적 방전에 의해 자외선대에 속하는 레이저빔을 방출하는데, 주로 불화세논, 염화세논, 불화크립톤, 불화아르곤과 같은 네 가지 기체가 사용되며, 이들은 각각 351, 308, 248, 193nm의 자외선을 방출한다. 매질의 구성성분에 따라 높은 출력의 157~351nm 자외선이 나오는데, 파장이 짧아서 열에 의한 조직의 손상은 미미하고, 주로 레이저가 세포를 이루고 있는 분자의 화학결합을 파괴하는 현상인 광해리(photodissociation)에 의해 조직이 파괴된다. 열 손상이 매우 적게 일어나므로 목표 부위를 정확하게 파괴하고 인접 조직은 손상하지 않는 장점이 있다.
큐스위치 루비레이저, 큐스위치 알렉산드라이트레이저, 큐스위치 엔디야그레이저와 같은 큐스위치 레이저는 큐스위치를 이용하여 극히 짧은 시간, 높은 순간 출력의 펄스파 레이저빔을 조사하여 광음향효과(photoacoustic effect)에 의한 충격파로 표적에 손상을 주어 조직을 파괴한다. 또한, CO₂레이저는 조직에 광열효과를 보이지만, 어븀야그레이저는 광기계적 효과를 보이므로 레이저 조사 시에 폭발하는 것과 같은 소리가 요란하게 들린다.
(3) 광화학효과(Photochemical effect)
모든 파장의 레이저광은 생체조직에 조사되어 흡수된 경우, 매우 낮은 출력에서는 세포의 파괴 없이 특정한 화학적 반응과 신진대사 반응을 일으키는 광화학적 상호작용이 일어난다. 저출력레이저요법(low level laser therapy, LLLT)은 1~500mW의 낮은 출력으로 피부에 열을 발생시키지 않고 피부 표면을 투과하여 광 에너지만을 신체의 내부에 전달하게 되며, 레이저빔을 흡수한 세포는 광 에너지를 화학적인 에너지로 전환하여 손상된 부위의 치유와 통증 완화에 이용하게 된다.
레이저가 처음 발명되고 얼마 지나지 않아 피부암에 대한 레이저 효과의 실험을 시작하였던 Mester 등은 1971년 저출력의 루비레이저가 외상으로 인한 상처와 화상의 재생을 자극한다는 사실을 처음으로 보고하였고, 이후 현재까지 LLLT는 조직의 재생, 통증의 완화, 염증의 치료 및 줄기세포의 증식 등 다양한 임상 분야에서 그 효과가 입증되고 있다. 예컨대, 저출력 헬륨네온레이저는 압박궤양에서 콜라겐 생성과 치료에 효능을 보여주는데, 이것은 생체자극 효과를 보이는 광화학적 작용이라고 할 수 있다. 1,064nm 엔디야그레이저를 저출력으로 사용하면 위와 같은 효과를 얻을 수 있고, 또한 세포를 죽이지 않으면서 DNA를 합성하지 못하게 하므로 콘딜로마에서 바이러스 증식을 억제하는 데 유용하게 사용된다. 같은 종류의 레이저라도 파장을 달리하면 신진대사에 다른 효과를 보이므로 파장이 1,320nm인 엔디야그레이저가 이런 목적으로 사용되고 있다. 또한, 아르곤레이저, CO₂레이저 등은 단백질 응고에 의한 미세혈관문합술에 응용되고 있다.
LLLT의 작용기전은 완전히 이해되지 않고 있지만, 단색성 및 가간섭성 빛이 표피를 통과하여 특정 진피 표적(발색단)에 흡수된 후, 세포 대사와 상처치유를 촉진시키는 효소들을 변화시키는 생체자극 연쇄 과정에 의한 것으로 생각되고 있다. 이러한 조직대사에 있어서 LLLT의 효과는 'laser biostimulation'으로 불리며, 조직에 대한 LLLT의 긍정적인 생체자극 효과는 잘 알려져 있다. 'low-intensity laser', 'low-power laser', 'cold laser'로도 불리는 LLLT 장비들은 단일, 가간섭성, 단색성 파장의 빛을 이용하기 때문에 비간섭성, 비단색성 및 다양한 파장의 빛을 방출하고 스폿 크기에 의한 제한이 없어 더 넓은 범위를 치료할 수 있는 LED와는 다르다. LLLT는 세포 고사를 막고 세포의 증식, 이동, 부착을 향상시키며, 레이저 조사 조직의 즉각적인 온도상승이 없는 비열성 반응을 보이는 낮은 수준의 에너지를 전달하므로 열, 소리, 진동이 없다.
LLLT는 초기에 헬륨네온(632.8nm), 루비(694nm), 아르곤(488, 514nm), 크립톤(521, 530, 568, 647nm)레이저가 주로 사용되었으나, 최근에는 600~1,100nm의 적색 및 근적외선 파장의 200mW 이하의 비열성 출력이 임상에서 사용되며, gallium arsenide(GaAs; 904nm)와 gallium aluminum arsenide(GaAlAs; 820, 830nm)와 같은 다이오드레이저가 주로 사용되고 있다.
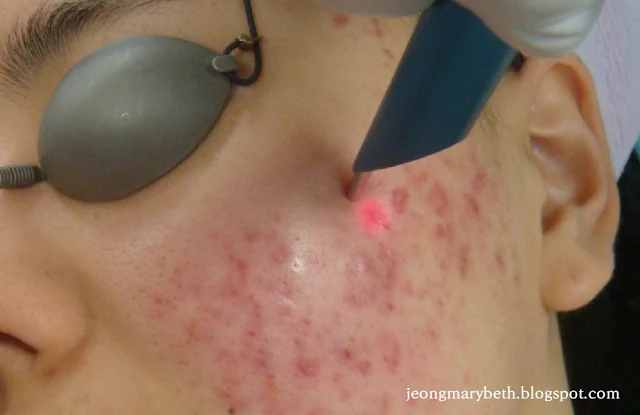 |
| 사진 3-6-F-16. 여드름에 585nm PDL을 광원으로 한 광역학요법 |
한편 광화학반응을 이용하여 악성 종양을 치료하기 위해서는 가변색소레이저(tunable dye laser)나 금증기레이저(gold vapor laser), 다이오드레이저 등이 사용되는데, 초기에는 파장조절이 가능한 색소레이저가 사용되었으나 유지관리가 어렵고 장치 크기가 커서 지금은 관리가 쉽고 간편한 다이오드레이저가 많이 사용되고 있다.
또한, 최근에 많이 이용되는 광역학요법(photodynamic therapy, PDT)은 약물과 광선이 상호작용을 하여 원하는 치료 효과를 거두는 치료법으로 우선 광선에 반응하는 물질인 광과민제를 원하는 세포에 침투시킨 후, 특정 파장의 광선을 조사하여 원하는 세포만을 선택적으로 파괴하는 일종의 광화학 요법이다.
PDT는 주로 종양 치료를 위한 목적으로 사용되어 왔다. 암세포에만 축적되는 광감작제를 암 환자에게 주사한 후 광감작제에 민감한 흡수 파장을 가진 레이저를 쪼여 암세포만 파괴하는 치료 방법으로 인식되어 왔고, 정상 세포에 피해를 주지 않고 암세포만을 선택적으로 공격하기 때문에 치료에 따른 합병증과 후유증이 적은 것이 특징이었다.
현재 피부질환에 대한 광역학요법은 접근의 용이성으로 인해 건선, 사람유두종바이러스질환, 혈관기형, 피지선과형성, 화농성 한선염 등의 비종양성 질환뿐만 아니라 광선각화증, 광선구순염, 유방외파제트병, 보웬병 등의 피부암 전구증과 표재성 기저세포암, 표재성 편평상피세포암, 각화극세포종, 카포시육종, 피부 T세포 림프종 및 균상 식육종, 악성 흑색종 그리고 피부전이암 등의 종양성 질환의 치료에 다양하게 사용되고 있다.
특히 2000년 Hongcharu 등은 여드름 환자에서 ALA와 적색광을 이용한 광역학요법으로 여드름 병변의 호전과 함께 피지의 분비가 서서히 감소하는 것을 관찰하였고, 또한 피부조직검사에서 피지선이 위축됨을 확인하였다고 보고함에 따라, 현재 광역학치료는 여드름 치료 외에도 과다한 피지, 넓은 모공의 치료에도 광범위하게 사용되고 있으며, 제모나 광회춘과 같은 미용 목적의 다양한 적용이 늘어가고 있다. 참고로, 광화학적 반응을 이용한 제모는 최근 일반적인 제모 레이저에 잘 반응하지 않는 비색소성 모발(non-pigmented hair)에 대한 효과적인 제모를 위한 대안의 하나로 부각되고 있는 것으로 알려진다.
참고문헌
1. 강진성. 성형외과학. Third Edition. Volume 4. 얼굴(3). 군자출판사 2004; 2034-48.
2. 김영식. 의료용 레이저. 광학과 기술 2010: 14 (2): 34-9.
3. 성경제, 최지호. 피부질환의 레이저 치료. 울산의대학술지 1995; 4 (2): 8-17.
4. 손정영. 레이저 응용-의과학분야. 전기의세계 1993; 42 (6): 18-25
5. 송순달. 레이저의 의료응용. 다성출판사 2001: 214-44.
6. 박승하. 레이저 성형. 군자출판사 2008: 2-4, 379, 381.
7. 범희승, 이종일. 바이오 의 광학. 전남대학교출판부 2007: 110-5.
8. 윤길원. 레이저의 의학적 응용과 전망. 한국광학회 하계학술발표회논문집 1995; 12: 2-6.
9. 이승헌, 박태현. 피부과 영역에서의 레이저 이용. 항공우주의학지 1995; 5 (1): 86-93.
10. 이욱. IPL의 원리와 그 이용. 대한일차진료학회/도서출판 엠디월드 2008: 36, 63.
11. 이충희. 레이저를 이용한 의료기술과 안전성 평가기술. New Physics: Sae Mulli 2012; 62 (6): 531-50.
12. 정종영. 임상여드름학. 도서출판 엠디월드 2014: 654-89.
13. 정종영. 임상적 피부관리. 도서출판 엠디월드 2010: 813-22.
14. 최지호. 피부과 영역에서의 레이저. 대한피부과학회지 1994; 32 (2): 205-16.
15. 함정희. 임상에 있어서 레이저의 이용/ 피부과에 있어서 레이저의 이용. 대한의사협회지 1992; 35 (12): 1475-81.
16. 허수진. 의학에서의 레이저의 응용. 울산의대학술지 1995; 4 (2): 1-7.
*1. Akaraphanth R, Kanjanawanitchkul W, Gritiyarangsan P. Efficacy of ALA-PDT vs blue light in the treatment of acne. Photodermatol Photoimmunol Photomed 2007; 23: 186-90.
*2Altshuler GB, Anderson RR, Manstein D, Zenzie HH, Smirnov MZ. Extended theory of selective photothermolysis. Lasers Surg Med 2001; 29 (5): 416-32.
*3. Anderson RR, Parrish JA. Selective photothermolysis: precise microsurgery by selective absorption of pulsed radiation. Science 1983; 220 (4596): 524–7.
*4. Degitz K. Phototherapy, photodynamic therapy and lasers in the treatment of acne. J Dtsch Dermatol Ges 2009; 7 (12): 1048-54.
*5. Habashi F. Witt and the Theory of Dyeing. Trends in Textile & Fash Design 2019; 3 (4): 640-3.
*6. Hongcharu W, Taylor CR, Chang Y, Aghassi D, Suthamjariya K, Anderson RR. Topical ALAphotodynamic therapy for the treatment of acne vulgaris. J Invest Dermatol 2000; 115: 183–92.
*7. Itoh Y, Ninomiya Y, Tajima S, Ishibashi A. Photodynamic therapy for acne vulgaris with topical 5-aminolevulinic acid. Arch Dermatol 2000; 136: 1093-5.
*8. Mester E, Spiry T, Szende B, Tota JG. Effect of laser rays on wound healing. Am J Surg 1971; 122 (4): 532-5.
*9. Mester E, Szende B, Spiry F, Sacher A. Effects of the laser in wound healing. Lyon Chir. 1971; 67 (6): 416-9.
*10. Sardana K, Garg VK. Lasers in Dermatological Practice. Jaypee Brothers Medical Pub 2014: 18-20.
*11. Tunér J, Hode L. Laser Therapy Clinical Practice & Scientific Background. Prima Books 2002: 75.
*12. Weber RJ, Taylor BR, Engelman DE. Laswe-Induced Tissue Reactions and Dermatology. In: Bogdan Allemann I, Goldberg DJ, Eds. Basics in Dermatological Laser Applications. Curr Probl Dermatol. Basel, Karger 2011; 42: 24-34.
*13. Witt ON, Über eine Filtriervorrichtung. Ber. d. Deutschen Chem. Ges 1886; 16: 918.
*14. Yadav RK. Definitions in Laser Technology. J Cutan Aesthet Surg 2009; 2 (1): 45–6.